专业知识
EGFR-TKI耐药机制可能取决于原EGFR敏感突变的外显子位置
2022-10-10 13:27:42
疾病进展时的肿瘤分子分析可研究肿瘤的演变。液体活检下一代测序(NGS)是一种无创、易获得肿瘤分子信息的检测技术。在这项研究中,收集了124例经一线EGFR-TKI治疗发生疾病进展的EGFR阳性晚期非小细胞肺癌(NSCLC)患者的血浆样本,对循环游离DNA (cfDNA)进行测序。除EGFR突变外,最常见的突变基因是TP53(57.3%),其次是APC(11.3%)、FGFR3(7.3%)和KRAS(5.6%)。根据最初EGFR敏感突变的位置,在疾病进展过程中检测到不同的分子变异。具体来说,p.T790M突变与EGFR外显子19突变的存在显著相关(Fisher p值:0.028)。所有KRAS激活突变(n=8)均在EGFR外显子18和21突变的肿瘤中检测到(Fisher p<0.001)。同样,NRAS和HRAS突变在EGFR外显子18或21突变的肿瘤样本中更常见(Fisher p值分别为0.050和0.099)。本研究数据表明,EGFR-TKI耐药机制可能依赖于原EGFR敏感突变的外显子位置。
研究背景
肺癌目前是一个严重的公共卫生问题。在美国,肺癌的发病率约占男女癌症病例的七分之一,四分之一的死亡病例是由肺癌引起的,是目前癌症死亡的主要原因。根据病理报告,肺癌主要分为非小细胞肺癌(NSCLC)和小细胞肺癌两大类,分别占病例总数的85%和15%。在NSCLCs中,EGFR阳性肿瘤定义了一种可能受益于靶向治疗的亚型。总体而言,EGFR突变主要在年轻患者、女性和亚洲人中检测到。据报道,EGFR阳性NSCLC的标准化年龄发病率为每10万人中有5例。
尽管EGFR抑制剂显著改善了EGFR阳性NSCLC患者的生存结果和生活质量,但治疗后总会出现耐药机制,导致肿瘤在2年内进展。目前,针对EGFR突变NSCLC患者新治疗策略的研究正在进行中。几种第三代EGFR-TKIs已处于临床研发的晚期,第四代EGFR抑制剂正在临床前阶段和I期试验中进行评估。同样,EGFR-TKI联合化疗或抗血管生成药物的疗效也在一些试验中得到了评估。其他药物组合,如第三代EGFR-TKI 拉泽替尼(lazertinib)+埃万妥单抗(amivantamab,一种针对EGFR和MET的人源化双特异性抗体)正在研究中。此外,据报道,超过三分之一的EGFR突变NSCLC患者在服用奥希替尼治疗进展后,接受拉泽替尼联合埃万妥单抗治疗显示出持久反应,这一结果令人鼓舞。
然而,EGFR阳性NSCLC患者可能出现不同的生存结局。一些EGFR突变NSCLC患者表现出特别好的预后,其进展时间超过30个月,而另一些患者在EGFR-TKI治疗开始6个月内被诊断为肿瘤进展。不同克隆群体引起的异质性可能是不同临床反应的基础。事实上,在早期EGFR阳性NSCLC患者中已经观察到克隆高度多样性。据报道,在EGFR阳性晚期NSCLC中,同时存在TP53或RB1突变的肿瘤表现出更高的组织学转化风险,且对EGFR-TKI的敏感性较低。在疾病进展时,对肺癌进行肿瘤活检通常是不可行的,或者活检可能不能反映继发性病变中可能出现的瘤内异质性和其他相关突变。在这种情况下,液体活检成为在疾病进展时进行肿瘤分子分析的一种值得关注的方法。
在本研究中,研究者通过对124例患者疾病进展时收集的血浆样本进行NGS分析,对EGFR阳性NSCLC进行了全面的探索性分析,以表征肿瘤进展的分子机制,并确定不同预后的分子机制。
研究结果
研究队列:
2016年2月至2021年9月期间,收集了124份一线EGFR-TKI治疗进展的晚期EGFR阳性NSCLC患者的血液样本。研究人群的临床特征见表1。患者多为女性(77例;62.1%)和从不吸烟者(71人;57.3%)。诊断时的平均年龄为65.8岁(范围:38-89岁)。共有116例(93.6%)为腺癌,其中IVB期居多(64例;51.6%)。大多数患者的东部肿瘤协作组体能状态(ECOG-PS)为0或1(72;58.1%)。所有患者均接受一线EGFR-TKI治疗:62例(50%)患者接受阿法替尼治疗,26例(21%)患者接受厄洛替尼治疗,33例(26.6%)患者接受吉非替尼治疗,3例(2.4%)患者接受奥希替尼治疗。
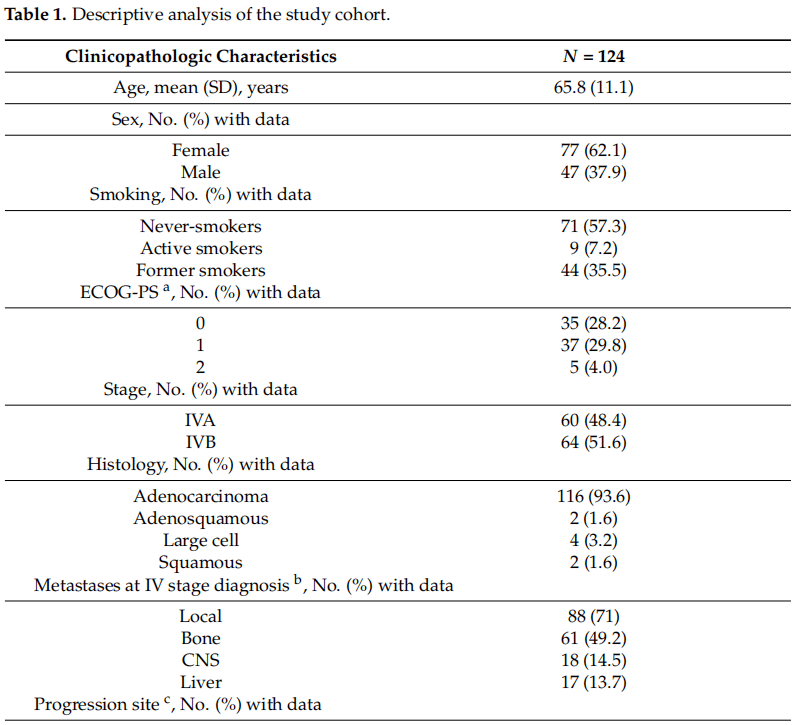
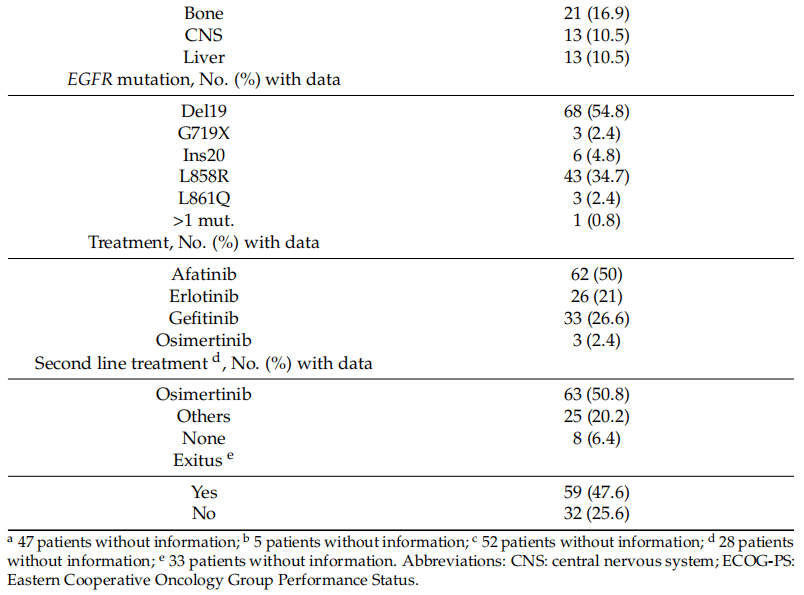
表1
根据病理学家的报告,68例(54.8%)肿瘤检测出外显子19缺失阳性,43例(34.7%)肿瘤携带外显子21点突变p.L858R,6例(4.8%)肿瘤存在外显子20插入。在3例(2.4%)患者中检测到外显子18的第719号密码子(p.G719X)点突变,外显子21的p.L861Q突变在3例(2.4%)患者中检测出。还有1名患者同时存在两种EGFR敏感突变,即位于外显子20的p.S768I突变和外显子19的p.E746_A750del缺失。
获得了91例患者的生存数据,中位随访时间为46.7(37.3~49.8)个月,中位OS为23.6(17.7~33)个月。
疾病进展的分子图谱:
总共在32个基因中检测到365个体细胞变异(图1)。最常见的变异类型是单核苷酸变异(SNVs,73.9%),其次是插入或缺失(indels,24.8%)和拷贝数变异(CNVs,1.3%)。


图1
每个样本检测到的平均突变数为2.9(范围:1-16),中位变异丰度(MAF)为5.2%(范围:0.1-77.7%)。除EGFR突变外,TP53突变频率最高,占57.3%,其次为APC(11.3%)、FGFR3(7.3%)和KRAS(5.6%)。在疾病进展过程中检测到TP53或APC致病性突变(5类或4类)患者的OS并不比未检测到突变的患者差。
如图1所示,研究者观察到普遍存在的共基因变异。具体来说,67.7%的样本携带与原EGFR敏感突变(在89例(71.8%)患者血浆样本中检测到)共存的突变。
与诊断为其他部位疾病进展的患者相比,仅在脑部发生肿瘤进展的患者经血浆检测发现原EGFR敏感突变更具挑战性(EGFR检出率分别为61.5%和76.3%)。相反,在肝脏发生疾病进展患者的所有样本中均检测到原EGFR突变(13/13)(p=0.015)。43例患者检测到EGFR p.T790M耐药突变。
在其他基因中也检测到致癌突变。具体来说,在两个病例中检测到功能获得性突变MAP2K1 p.P124L。此外,在1例患者中检测到PIK3CA p.E545K突变。该突变在基线和治疗开始3个月均未出现,进一步证实了其是耐药突变(表2)。同样,1名病例在疾病进展过程中检测到BRAF p.V600E突变,而在之前收集的样本中检测为阴性(表2)。

表2
在7个样本(5.6%)中检测到8个KRAS致癌突变,即p.G12C、p.G12V、p.G12S、p.G12D、p.G15V、p.Q61R、p.Q61H和p.A146T(表3)。其中,由于相应病例的之前样本中未检测到p.G12C、p.G15V、p.Q61H和p.G12D突变,因此推测这些突变为获得性耐药机制。相反,KRAS p.A146T突变在基线时就被检测到,对应患者的PFS(2.8个月)是所有KRAS阳性病例中最短的(表2)。
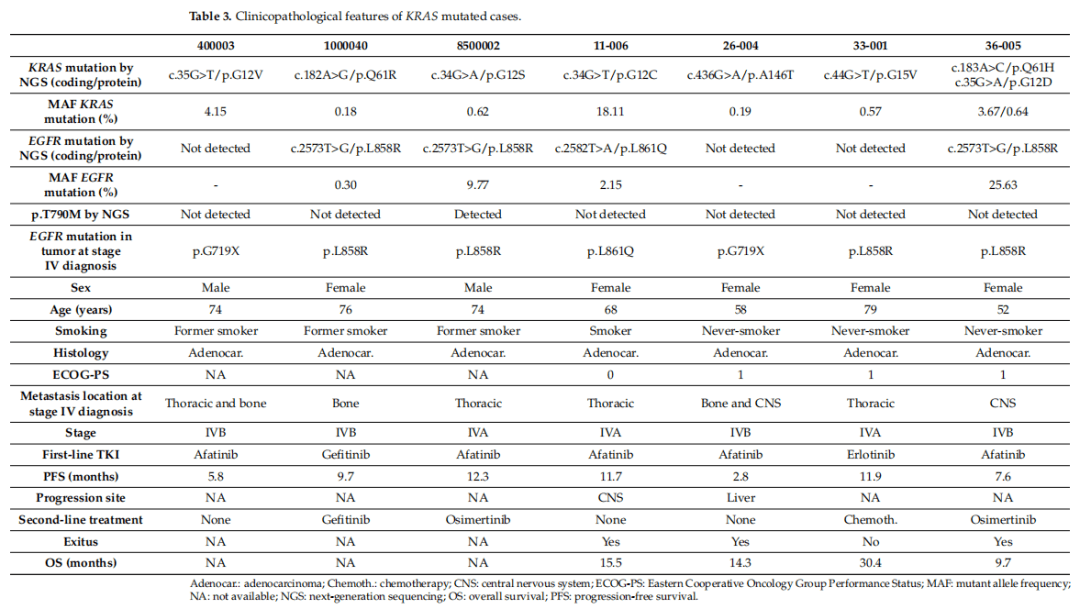
表3
在5例患者中检测到EGFR (n=3)、MET (n=1)和ERBB2 (n=1)CNVs。其中3例患者的治疗前样本中没有这些CNVs,另外2例在基线时检测到MET或EGFR扩增。基线时检测到CNVs的患者PFS最短(2.8和3.9个月),提示分别通过MET或EGFR扩增产生原发耐药性(图2)。
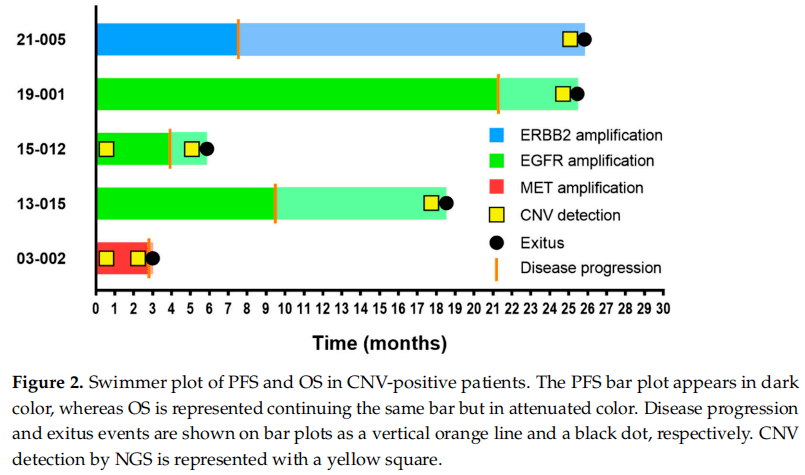
图2
原EGFR敏感突变的外显子位置决定了疾病进展的不同分子特征:
与EGFR外显子21突变的肿瘤相比,EGFR外显子19突变的肿瘤检测到p.T790M突变的频率更高(p=0.028)。在p.T790M阴性病例中,有2名病例在疾病进展时携带临床可操作突变,其中包括KRAS p.G12C突变和MET扩增。在一例患者中检测到可用药BRAF p.V600E突变,该病例携带EGFR外显子19缺失和p.T790M突变。
研究者进一步评估了其他特定的基因共变异是否与EGFR外显子相关。研究者比较了外显子19突变的肿瘤样本与外显子21突变的肿瘤样本中基因共变异的频率,结果显示,在EGFR外显子18和21上发生敏感突变的肿瘤中,KRAS突变显著富集(p<0.001)(图3)。值得注意的是,KRAS突变病例(n=7)中有3例存在不常见的EGFR突变:2例为p.G719X突变,1例为p.L861Q突变。不常见的EGFR敏感突变与KRAS突变之间的相关性也很显著(p=0.002)。
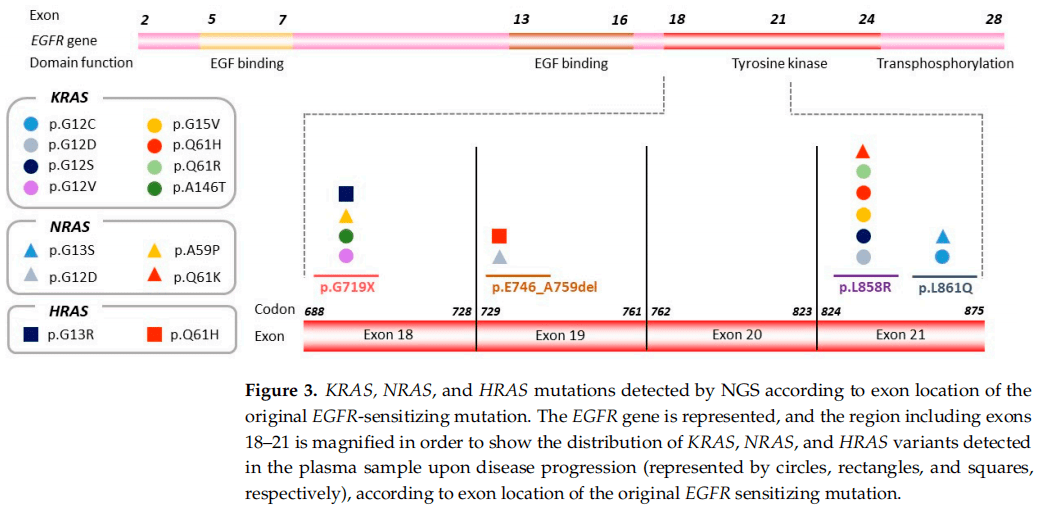
图3
在NRAS (n=4)和HRAS (n=2)中也观察到类似的模式,在18或21外显子突变的肿瘤样本中,这些基因突变检出率更高(分别为p=0.050和p=0.099)(图3)。
循环肿瘤DNA的预后价值:
研究者使用不同的方法评估循环肿瘤DNA(ctDNA)水平的预后价值,从每个样本的所有检测变量集合中计算MAF的平均值、最大值和总和,并建立了不同的MAF阈值(范围从1%到10%)。此外,研究者还评估了原EGFR敏感突变MAF的预后价值。如表4和图4A所示,无论采用何种方法,ctDNA的量都具有预后意义。总的来说,在疾病进展阶段,ctDNA高的患者的OS明显比其他患者更短(表4和图4A)。MAF阈值<5%的Kaplan-Meier曲线如图4B-E所示。采用MAF总和<5%的阈值时,ctDNA水平高(MAF≥5%)的患者中位OS为16个月(95%CI: 14~21.2),而ctDNA水平低于该阈值的患者中位OS为43.7个月(95%CI:23.6~NR)。
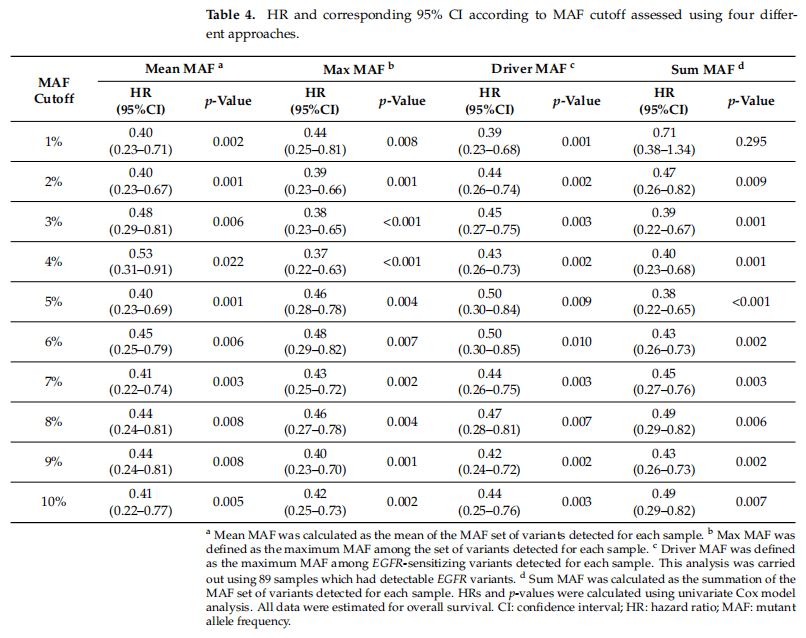
表4
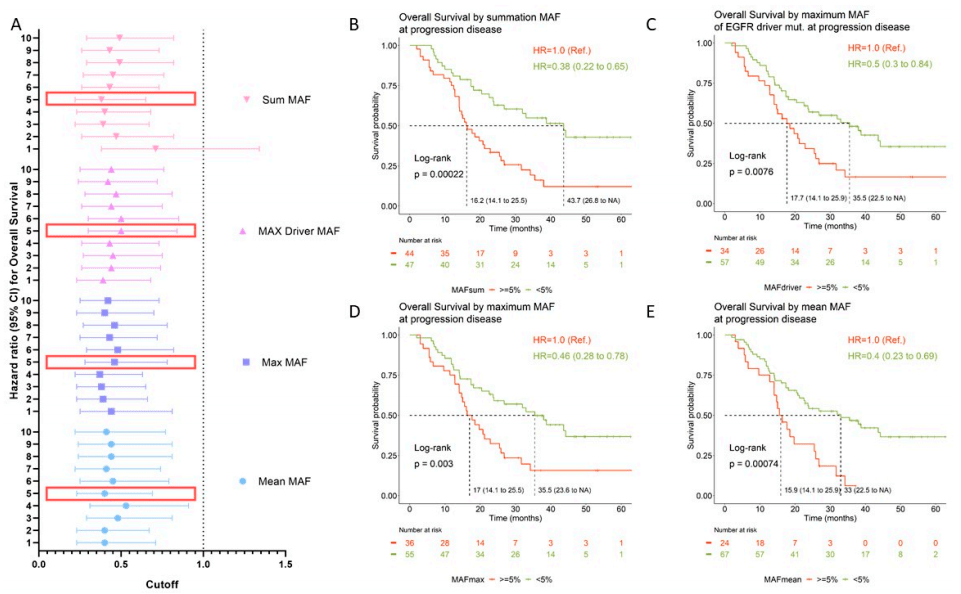
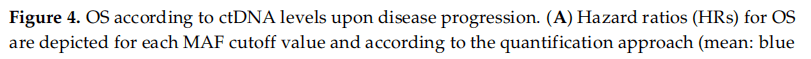

图4
讨论
到目前为止,已报道了几种不同的EGFR抑制剂相关获得性耐药机制。耐药突变的多样性突出了肿瘤异质性在肿瘤对靶向治疗耐药方面的重要性。据研究者所知,本研究首次报道了EGFR-TKI耐药机制——获得性KRAS突变可能依赖于原EGFR敏感突变的外显子位置或突变类型,这表明肿瘤耐药可能由原EGFR突变在基因组中的位置驱动。鉴于EGFR突变NSCLC患者检测到原敏感突变的外显子不同,对靶向治疗具有不同的敏感性,这一假设是合理的。在本队列中也观察到了这种情况。换言之,EGFR阳性NSCLC可以根据EGFR敏感突变的位置划分为不同的亚型,其生存结局也不同。与EGFR外显子19缺失和外显子21点突变不同,大多数含有EGFR外显子20插入突变的NSCLC患者无法从EGFR-TKIs中获益,据报道其反应率低于5%,疾病控制期较短。
总的来说,TKI耐药可分为EGFR依赖性机制和EGFR非依赖性机制。p.T790M突变是第一代和第二代EGFR-TKIs治疗的NSCLC患者中最常见的耐药机制。在本研究中,p.T790M突变明显更频繁地在外显子19突变的肿瘤中被检测到。这一发现与以往的报道一致。此外,在本队列中,在5例病例中检测到EGFR、MET和ERBB2扩增。MET扩增已被确定为阿法替尼、吉非替尼、厄洛替尼和奥希替尼的耐药机制。有研究报道,EGFR和MET的双重抑制是一种很有前途的治疗策略。同样,在厄洛替尼、吉非替尼和奥希替尼治疗的肿瘤中也观察到获得性耐药机制ERBB2扩增。在3例病例中发现了MAP2K1和PIK3CA致癌突变。众所周知,激活下游EGFR信号通路如MAPK/ERK或PIK3CA/AKT信号通路在EGFR-TKI耐药中起重要作用。同样,获得性BRAF突变已被证明与EGFR-TKI耐药相关。在本队列中,在一位肿瘤外显子19缺失的患者中,BRAF p.V600E突变和p.T790M耐药突变同时被检测到。Chao-Chi Ho等人的一份病例报告报道了一名p.T790M患者在接受奥希替尼治疗时,在病情进展期间获得BRAF p.V600E突变。在本研究中,ctDNA分析是用一个相对较小的NGS panel进行的,该panel覆盖52个基因的热点变异。因此,这些结果应谨慎解释,并须在更大的队列研究中进行验证。
KRAS突变在EGFR外显子18和21突变或不常见突变的肿瘤中更常被检测到,这一事实可能对临床试验评估双重或连续EGFR和KRAS阻断疗效的发展具有重要意义。此前已有文献表明,在接受EGFR-TKI一线治疗的EGFR阳性NSCLC患者中,大约1%的患者中发现了KRAS p.G12C可药物突变,且该突变往往出现在含有EGFR不常见突变的肿瘤中,这支持了本研究结果。
疾病进展时ctDNA的含量与OS显著相关。大量证据表明ctDNA水平与肿瘤体积显著相关,因此可用于疾病监测。此外,ctDNA水平具有预后意义。事实上,有研究者建议将ctDNA包含在肿瘤分期系统中。然而,目前还没有很好地确定ctDNA应该如何测量,特别是当肿瘤没有可用药突变时。作为一种探索性的方法,本研究使用不同的方法(所有检测到的突变的MAF中值、所有检测到的突变的MAF最大值、原EGFR敏感突变的MAF和所有检测到的突变的MAF总和)评估预后价值,得到了相似的结果。
在疾病进展过程中观察到不同的分子异质性变异,突出了异质性驱动肿瘤耐药的重要性。本研究数据表明,耐药机制可能依赖于原EGFR敏感突变的外显子位置。需要进一步的研究来证实这一观察结果。
参考文献:
Serna-Blasco R, Sánchez-Herrero E, Robado de Lope L, Sanz-Moreno S, Rodríguez-Festa A, Ares-Trotta D, Cruz-Bermúdez A, Franco F, Sánchez-Hernández A, Campayo MJ, García-Girón C, Dómine M, Blasco A, Sánchez JM, Oramas J, Bosch-Barrera J, Sala MÁ, Sereno M, Romero A, Provencio M. Molecular Divergence upon EGFR-TKI Resistance Could Be Dependent on the Exon Location of the Original EGFR-Sensitizing Mutation. Cancers (Basel). 2022 Sep 13;14(18):4446. doi: 10.3390/cancers14184446. PMID: 36139605; PMCID: PMC9496947


